
춘천교육지원청 영재교육원 과학 2024
: 여러가지 화학반응
봄내중학교 - 봄내중 고준


춘천교육지원청 영재교육원 과학 2024
: 여러가지 화학반응
봄내중학교 - 봄내중 고준
Ⅰ. 산과 염기
어른들이 가끔씩 하는 말 중에 '공짜라면 양잿물도 마신다'라는 말이 있다. 양잿물이란 옛날에 빨래할 때 사용하던 물질로 가성소다라고도 불리는 수산화나트륨을 물에 녹인 것을 말한다.
수산화나트륨은 강한 염기성을 나타내는 물질이다. 이것을 만지면 미끌미끌한데, 이것은 염기성 물질이 단백질을 녹이는 성질이 있기 때문이다. 즉, 염기성인 수산화나트륨이 피부 속에 포함된 단백질을 녹이기 때문에 미끌거리는 것처럼 느껴지는 것이다.
그런데 살을 녹이는 물질을 마시겠다고? 세상에 공짜 좋아하지 않는 사람이 어디 있으련만, 어떻게 양잿물을 마신단 말인가! 결국 이것은 공짜라면 몸에 독이 되는 것도 마다하지 않을 정도로 무조건 좋아하는 태도를 비꼬는 말이다.
이러한 수산화나트륨처럼 만지면 미끈미끈한 성질을 가진 염기성 물질을 화학에서는 '염기'라고 한다.
한편, 물질들 중에는 염기와 반대적인 성질을 가진 물질들이 있다. 바로 '산'이라는 산성 물질들이다.
우리 주변에서 쉽게 볼 수 있는 산성 물질로는 식초를 들 수 있다. 식초를 달걀 껍데기에 몇 방울 떨어뜨리면 작은 거품이 일어나는 것을 볼 수 있는데, 이것은 산성 물질이 달걀 껍데기의 탄산칼슘 성분과 반응하여 껍질을 녹이기 때문이다.
이처럼 산은 달걀 껍데기나 대리석 등에 포함된 탄산칼슘을 녹이고, 심지어 강한 산성 물질은 금속까지 녹이는 성질을 가지고 있다.
[네이버 지식백과] 산과 염기 (상위5%로 가는 화학교실2, 2008. 3. 31, 신학수, 이복영, 백승용, 구자옥, 김창호, 김용완, 김승국)
Ⅱ. 중화반응
봄이 되면 황사의 빈도가 높아진다. 중국 또는 몽골의 사막 지대에서 발생한 황사는 편서풍을 타고 우리나라에 도달한다. 시간당 미세 먼지의 농도가 세제곱 미터당 800 마이크로그램(800 μg/m3)이상이 될 때 황사경보를 내리는데, 황사는 매우 크기가 작은 모래나 황토로 되어 있다. 주요 성분은 지각에 많이 분포해 있는 알루미늄을 비롯한 각종 금속 산화물과 탄산염이지만, 중금속이 포함되기도 한다.

일반적으로 중금속이 많이 포함된 황사는 자연과 인간 모두에게 이롭지 못하다. 그런데 이런 황사가 우리 생활에 다양하게 영향을 미치고 있다.황사가 심해지면 호흡기 질환 환자들이 늘어나고, 정밀 기기의 오작동도 빈번해진다.
그러나 황사가 무조건 나쁜 영향만을 주는 건 아니다. 정량적이고 과학적인 측정과 평가를 하기 쉽지 않겠지만, 염기성 성분을 띠는 황사는 산성화된 강이나 호수는 물론 산성화된 토양과 중화반응을 일으키는데, 이는 황사의 긍정적인 영향이라 볼 수 있다.
[네이버 지식백과] 중화반응 - 산과 염기의 반응 (화학산책, 여인형)
Ⅲ. 산화와 환원
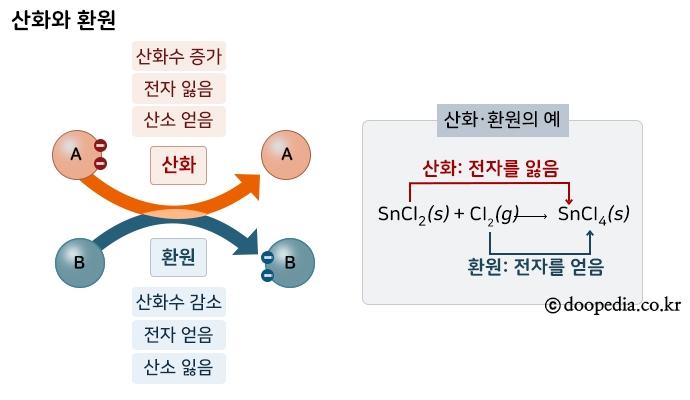
반응물 간의 전자 이동으로 일어나는 반응으로 산화와 환원이 동시에 일어난다. 전자를 잃은 쪽을 산화되었다고 하고 전자를 얻은 쪽을 환원되었다고 한다. 이때, 잃은 전자수와 얻은 전자수는 항상 같다.
산화·환원반응이 일어날 때 산화수의 변화가 일어난다. 산화수란 일반적으로 이온으로 되었을 때 전하량이다. 이온의 종류가 두 개 이상인 철과 같은 원자의 경우에는 공유결합을 이루는 전자가 전기음성도가 더 큰 원자에 속해있다고 했을 때의 전하량을 생각하면 된다.
홑원소물질과 중성화합물의 산화수는 0, 이온의 산화수는 이온의 전하량, 산소원자의 경우에는 보통 -2, 과산화물에서는 -1이고 수소원자의 경우 보통 +1, 금속화합물에서는 -1이다. 산화수를 계산할 때에는 이온화가 잘 되는 1족, 2족, 17족과 같은 원소들의 산화수를 먼저 생각해주는 것이 쉽다. 산화된 물질은 전자를 잃게 되므로 산화수가 증가하고, 환원되는 물질은 전자를 얻으므로 산화수가 감소한다.
예를 들어 SO42-는 O의 산화수가 -2이고 총 4개 있으므로 -8인데 화합물 전체의 산화수가 -2이므로 S의 산화수는 +6이된다. NH3는 H의 산화수가 +1이고 총 3개 있으므로 +3이고 화합물 전체의 산화수가 0이므로 N의 산화수는 -3이다. 반면 HNO3의 경우 H의 산화수 +1, O의 산화수는 -2이고 3개 있으므로 -6인데 화합물 전체의 산화수가 0이므로 이 때 N의 산화수는 +5가 된다.
산화환원반응에서 각 원소의 산화수를 계산하여 어떤 물질이 산화 또는 환원되었는지 쉽게 알 수 있다.
SnCl2(s) + Cl2(g) → SnCl4(l) <ub> </ub>
각 반응물의 산화수를 보면 다음과 같다.
Sn : +2 → +4 : 산화수가 증가했으므로 산화되었다.
Cl2 (g) : 0 → -1 : 산화수가 감소했으므로 환원되었다.
산화환원반응의 가장 대표적인 경우가 화학전지이다. 아연과 구리로 만들어진 화학전지(다니엘전지)의 경우, 아연이 전자를 잃고 산화되고 구리는 전자를 얻고 환원된다.
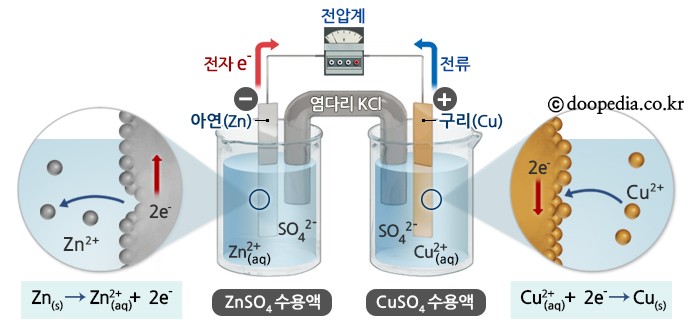
전체 반응식은 다음과 같다.
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
자신은 환원되면서 다른 물질을 산화시키는 물질을 산화제, 반대로 자신은 산화되면서 다른 물질을 환원시키는 물질을 환원제라고 한다. 따라서 전자를 얻는 성질이 강할수록 강한 산화제, 전자를 잃는 성질이 강할수록 강한 환원제이다.
산화수와 산화·환원
산화수란 물질 중의 원자가 어느 정도 산화 또는 환원 되었는가를 나타내는 수치로, 산화수의 증가 감소로 산화 환원 상태를 나타낸다. 이온 결합 물질에서는 산화수가 물질을 구성하고 있는 이온의 전하와 같다, 그러나 공유결합성 물질에서는 산화수가 공유 전자쌍을 전기 음성도가 큰 원소가 완전히 차지했다고 가정했을 때 그 원소가 가지는 전하를 나타낸다. H2O의 경우는 O의 전기 음성도가 H보다 크므로 공유 전자쌍을 산소가 모두 가졌다고 가정하면 O는 전자 2개를 얻는 것과 같으므로 산화수가 -2가 되고 H는 전자 1개를 잃은 것과 같으므로 산화수가 +1 이 된다.
[네이버 지식백과] 산화와 환원 (통합논술 개념어 사전, 2007. 12. 15., 한림학사)
[네이버 지식백과] 산화환원반응 [oxidation-reduction reaction, 酸化還元反應] (두산백과 두피디아, 두산백과)
춘천교육지원청 영재교육원 과학 2024
: 여러가지 화학반응
봄내중학교 - 봄내중 고준
강원특별자치도춘천교육지원청 홈페이지 (gwe.go.kr)
강원특별자치도춘천교육지원청 홈페이지
gwcce.gwe.go.kr
춘천교육지원청 영재교육원 과학 2024
: 여러가지 화학반응
봄내중학교 - 봄내중 고준
봄내중학교
강원특별자치도 춘천시 공지로200번길 36
map.kakao.com